 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SANOFI CUENTA CON AUTORIZACIÓN MUNDIAL PARA DUPILUMAB.
* Es el primer tratamiento específico para adultos con Dermatitis Atópica moderada a grave, que puede afectar aspectos de la calidad de vida, como el sueño, la ansiedad y la depresión.
Sección a cargo de G. Adolfo Ruiz J.
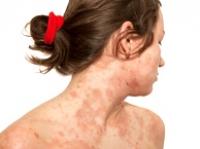
CDMX 17 julio 2018.- Sanofi anunció que la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) otorgó la aprobación de Dupilumab para tratar pacientes adultos con dermatitis atópica moderada a grave, cuando los tratamientos tópicos preexistentes son insuficientes para controlar la enfermedad o no son candidatos a esa terapia. Dupilumab es la primera terapia biológica en México que ataca el origen inmunológico de la dermatitis atópica.
La dermatitis atópica, es una enfermedad inflamatoria crónica que provoca con frecuencia erupciones en la piel. La dermatitis atópica moderada a grave se caracteriza por inflamación que cubre gran parte del cuerpo e incluye comezón intensa y persistente, resequedad, agrietamiento, enrojecimiento, costras y supuración en la piel. La comezón es uno de los síntomas más molestos, ya que puede llegar a ser debilitante. Además de estas manifestaciones, las personas con esta enfermedad experimentan síntomas como lesiones en la piel, ansiedad y depresión.
“La aprobación de Dupilumab demuestra nuestro enfoque como empresa para transformar la innovación científica en soluciones de salud, que hacen una diferencia significativa en la vida de las personas que viven con dermatitis atópica moderada a grave. Esto representa un hito en el manejo de la dermatitis atópica, no sólo para Sanofi, sino para todos los profesionales de salud que finalmente podrán ofrecer a sus pacientes el control de esta enfermedad”, señaló, Félix Scott; Country Chair de Sanofi México.
El Doctor. Antonio Loaeza; Director Médico de Sanofi México, indicó que “Dupilumab representa la culminación de décadas de investigación científica sobre enfermedades inmuno-alérgicas como la dermatitis atópica, en la que Sanofi brinda una nueva esperanza para aquellos pacientes que con los tratamientos actuales no logran el control de la enfermedad.
Con este primer y único anticuerpo monoclonal humano indicado para la dermatitis atópica moderada a grave en adultos, ayudaremos a los pacientes a mejorar la función de su piel, controlar signos y síntomas como: lesiones y comezón intensa que causa la enfermedad, así como mejorar su calidad de vida”.
Dupilumab es un anticuerpo monoclonal humano que inhibe selectivamente la señalización de dos proteínas clave, IL-4 e IL-13 (interlucinas), que son consideradas las principales impulsoras de la inflamación subyacente de la dermatitis atópica. Dupilumab solo o con corticosteroides tópicos proporciona una rápida mejoría en la extensión y gravedad de la lesión, intensidad de la comezón, así como en la calidad de vida.
Este tratamiento fue aprobado por la Agencia de Administración de Alimentos y Medicamentos (FDA) y la Agencia Europea de Medicamentos (EMEA) en 2017 y es la única terapia biológica aprobada en estos mercados para el tratamiento la dermatitis atópica moderada a grave. Dupilumab se ha desarrollado como parte de un acuerdo de colaboración global entre Sanofi y Regeneron.
Acerca de Dupilumab
Es un medicamento que se utiliza para el tratamiento de los adultos con dermatitis atópica de moderada a grave (denominada eccema atópico, que consiste en comezón intensa, enrojecimiento y diferentes lesiones húmedas o secas en la piel). Este tratamiento cuenta con 19 estudios clínicos finalizados, además reduce los brotes y el picor, de tal forma que mejora la calidad de vida del paciente adulto.
Acerca de Sanofi
Está dedicada a apoyar a la gente a superar sus retos en salud. Somos una compañía bio-farmacéutica global enfocada en la salud humana. Prevenimos enfermedades con vacunas, proveemos tratamientos innovadores para combatir el dolor y aliviar el sufrimiento. Apoyamos a los pocos que sufren enfermedades raras, así como a los millones con condiciones crónicas permanentes.
Publicado: 17/07/2018
PORTADA | FAVORITOS | RSS | CONTACTO | BUSCAR | IMPRIMIR
ESPECTÁCULOS TURISMO CINE. TV Y DVD SEGURIDAD TECNOLOGÍA INSTITUCIONES RESP. SOCIAL LIBROS EVENTOS ESPECIALES EXPOS Y FERIAS DEPORTES MODA Y BELLEZA AVANCES MÉDICOS
Sitio Web diseñado por EspacioMéxico

